Home | ホームページ設立の趣旨 | 掲載予定の記事について
豊倉賢略歴 | apppendix | 新規掲載記事
2007B-3 川喜田 哲哉 千葉工業大学・日本大学生産工学部 非常勤講師
| 略歴 | |||
| 1999年 3月 | 博士後期過程終了 | ||
| 1999年 4月 | 東邦ガス株式会社入社、総合技術研究所配属 | ||
| 以降、現在に至る。 | |||
|
賞罰 |
|||
| 1999年 3月 | 早稲田大学水野賞受賞 | ||
| 2005年 6月 | 日本ガス協会論文賞受賞 |
「 分離工学序説 」
千葉工業大学 非常勤講師
日本大学生産工学部 非常勤講師
川喜田 哲哉
|
|
(1) |
で与えられる。アメリカでの市場価格(M:$/lb)と物質の濃度(C:重量分率)との間には
|
|
(2) |
| k=1、Aは有機物および無機物で決まる定数 | |
の関係が成立つようである。これは(1)式からの予想とは異なり、logMが−logCに比例している。実際に濃度の薄い原料から、純粋の製品にまで仕上げるのに必要なエネルギーは、取り扱う原料の量に比例するようである。たとえば目的物1%を含む原料から100%回収可能とすると1tの製品を得るための原料は100tであり、0.01%(100ppm)なら原料は104t必要となる。ここで(1)式の対数比例関係は原料1t当たりの処理コストが同じならば肯首できることである。無機関連の製品および有機物関連製品各々ではこの関係はよく成立つが、無機物製品に比べて有機物製品では同じ濃度での製品を比較すると1桁程度コストは高くなっている。市販価格が製造コストに比例するとの仮定では、有機物は分離方法の改良によって、もう一段コスト切り下げが可能なのではないかとの示唆を与えている。またこのデータより、原料中の含有率を高める方策は製造コスト削減に大きな寄与することも分かる。
バイオ関連では培養液中の蓄積濃度を上げる研究開発に多くの努力が払われているのは肯ける方策と云える。また医薬品や食品においては、品質の中でも安全性の観点から用いる分離方法への制約も考慮して分離方法を選択する必要がある。
製品が高価であるということは、その製品のマーケット規模も小さく、したがって生産量も少なく規模のメリットも出ないために高価になるということでもある。
バイオプロダクトでの分離精製
発酵工業における分離精製コストは全製造コストの約40〜60%であるが、最近のnew−Biotechnologyにおける分離精製コストは80〜90%になるとも云われている。この大きな原因は培養によって生成する目的物質の濃度が低いことと目的物質と類似の不純物が多いことがそのおもな理由である。
製品の純度を高めるには各種の分離方法(単位操作)を直列に組み合せることになるが、単位操作が多段になると収率(η)は一段での収率をλとすると
|
|
(3) |
で与えられるから例えば1段の収率が90%であっても4段で65.6%であり、80%のときは4段で41%と落ちざるを得ない。
ここで仮に製造プロセスの総段数を5段として各段での回収率(収率)を80%、各段での単位精製費用を$0.5としたときの綜合収率と綜合精製費用をまとめると表‐1のようになる。ただし付加価値の算出は累積費用/単位生産量で求めた。
|
表-1 分離精製プロセスの収率と精製費用 |
|||||
| 段数 | 収率 (%) |
生産量 (単位) |
プロセス費用 ($/単位) |
累積費用 ($/単位) |
付加価値 ($/単位) |
1 2 3 4 5 |
培養液 80 80 80 80 80 |
3.05 2.44 1.95 1.56 1.25 1.00 |
1.00 0.5 0.5 0.5 0.5 0.5 |
3.05 4.27 5.25 6.03 6.65 7.15 |
1.00 1.75 2.69 3.87 5.32 7.15 |
この表で示したように上流ほど処理量が多くなりコストもかかる。培養工程のコスト(ここでは$1/単位とおいた)は大きいので、収率の低い精製工程は培養工程のコストを増加させることになる。このことより分離精製工程の収率向上は分離精製工程のコストのみならず培養工程のコスト削減にもなるので、分離精製での収率向上は非常に重要である。
また分離精製工程の各段での単位操作の収率が向上したときの付加価値を見ると下流に行くに従いプロセス流体の価値が増加するので、下流には収率が高い単位操作を置くことがプロセス構築には肝要である。また単位操作の収率向上にも自ずから限度があり、設備固定費の面からも組み合せる単位操作の段数をできるだけ少なくすることが綜合収率向上にも役立つ。
分離精製プロセスの構築に当たって重要な観点は製品のコストであり、品質である。 品質を代表するものは純度であり、コスト特に変動費に関わってくるのは収率である。純度は分離精製プロセスを構築するときの設計要件として与えられるものでこれを達成するために適切な単位操作の組み合せとその各々の操作条件を見つけだして、かつ先に述べたように最小の単位操作段数とその最もよい配列を決定しなければならない。
ここで重要なことは、これらの決定は出来るだけ短期間に行う必要があるので、現在ある技術水準のもとでこれらを行う必要がある。
分離精製での単位操作
化学工学での単位操作は、物質の状態変化、凝集状態の変化、エネルギー変換などの主として物理的変化を与える操作である。分離精製は、混合溶液から目的成分のみを取り出すか、または不純物を取り除くかの操作であり、古くから蒸留、抽出、吸収、晶析などの単位操作が分離操作として検討されてきた。目的成分のみを取り出すか、または不純物を取り除くかのいずれにおいても物質の移動でありこれにより分離されることより物質移動操作とも云える。このような物質移動が起こるのは、分離すべき物質の物理的、化学的または生化学的性質に基く平衡または移動速度の差が原因である。
物質に働く力を熱力学的力で表すと
|
|
(4) |
である。右辺の第1項は化学ポテンシャルによる力であり、第2項は圧力、第3項は電位差による第4項は外力の作用による力である。(4)式でΦ=0のときが平衡状態を表している。また物質移動に関わる物理的、化学的、生化学的性質をまとめたのが表‐2である。
| 表-2 分離に関わる性質 | ||
| 物理的性質 | 化学的性質 | 生化学的性質 |
| 力学的性質 密度・表面張力・形状 熱力学的性質 相平衡(溶解度)、沸点 転移点・蒸気圧・吸着平衡 輸送的性質 粘度・拡散係数 電気・磁気的性質 移動度・磁化率 |
熱力学的性質 化学平衡 反応速度論的性質 反応速度定数・解離定数 イオン化、解離 |
物質認識 輸送的性質 刺激応答 |
これらの差異が物質の移動と結びついて分離出来ることになる。
また、分離を生じる系を分離の現象で見てみると、蒸留・抽出・晶析のように多数の分子やイオンが外部条件の変化により平衡がシフトし一つの熱力学的平衡状態から他の熱力学的平衡状態へ組成変化を起こして分離がおこる平衡分離の場合と、電気透析・膜分離のように分離場の中で個々の離散的な分子の移動速度差による分離とに大別することができる。
分離の仕方
海水をくみ上げて適当な容器に入れて加熱蒸発操作により粗塩を得ることができる。このような1段では十分な分離が出来ない場合がある。例えば数%のエタノールを含む発酵役を単蒸留器で分離すると20数%のエタノール溶液が限度である。これは一般に焼酎、泡盛などの蒸留酒となるが、これをもう一度単蒸留器で分離するとエタノール濃度は60%程度となりアブサンのような強い酒になる。
このように1段処理では分離の程度が低い時は何度も反復処理を行わなければならないことが多い。この反復の仕方に回分式と連続式がある。
回分式には(1)単蒸留器でのエタノール濃縮のように1段の装置で張り込み−分離−排出を繰り返す方法、(2)固体粒子の充填層の先端に混合物を一定量注入し、成分の特性によって充填層内中の移動速度の差を利用して低部より分離ピークとしてそれぞれの成分を分取する“クロマトグラフ式”の非定常分離法がある。
連続式では、単蒸留器、抽出器などの、それぞれの分離目的に適した分離装置を何段にもつないだカスケードのある適当な段に分離すべき混合物を連続的に供給し、一方の端より成分の濃縮された製品流れを取り、他端から希薄になった製品流れを取り出す。この結果定常分離状態が達成される。
イオン交換樹脂塔のような固体粒子の固定層からなるカスケードでは上部より原料を供給すると時間とともに固体粒子の吸着量が変化している吸着帯は下部に移動し、A成分(イオン)は取り除かれた流体が低部から出てくる。流体を製品と見ると連続式と見られるが固体粒子は非定常でかつ回分式である。固体粒子に吸着したA成分は再生工程で除去され、固体粒子は再利用される。この再生工程で固体粒子の電気化学ポテンシャルは増大しA成分の吸着のときにエネルギーが(流体+A)混合物を分離するための負のエントロピーとして消費されている。
また、移動層吸着を考えると、再生された固体粒子を他端より供給し反対側より(流体+A)を供給する向流カスケードでは原料供給端では飽和吸着した固体粒子が取り出されて再生装置に入り、A成分と固体粒子は分離される。このときイオン交換帯はこのカスケード内では移動しない定常吸着分離装置となる。このときの交換帯の長さは非定常の場合よりも広がる傾向にある。
連続向流抽出装置や連続向流ガス吸収装置では多くの場合、分離装置から出る抽出溶剤およびガス吸収溶媒におけるA成分の濃度は原料混合物中のA成分濃度と平衡な濃度以上にはならない。もし、A成分の濃度をこの平衡濃度以上にする必要がある場合にとる手段が還流(Reflux)である。還流を行うことによりA、B2成分の分離も可能になる。
連続蒸留では混合物(A+B)が供給される原料段より下部を低沸点成分Aを回収する回収部、上部をA成分を濃縮する濃縮部と呼んでいる。回収部の下に設置されたスチルでは熱エネルギー(Q)を投入し温度T1の蒸気が蒸留塔内を上昇する。原料段では混合物(A+B)と平衡な蒸気がさらに上昇し、A成分の濃縮された蒸気は最上段のコンデンサーで温度T2に冷却凝縮され液体となった一部は還流される。
このときの蒸留装置でのエントロピー生成速度は温度はT1>T2であるから
|
|
(5) |
となり、エントロピー生成速度は負となることが分かる。これが分離の原理である。
バイオ分離精製プロセスの基本構成
バイオ分離精製工程はその製品毎に異なるが、共通するところに着目して単純化すると図?1のようになる。
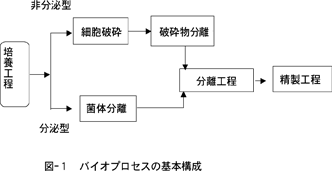
大腸菌によるインシュリン、インターフェロンのように目的物質が菌体内に蓄積される場合は分離した細胞を破砕するか、溶剤による抽出を行う必要がある。細胞破砕または抽出後、遠心分離あるいはろ過により固形分等を分離する前処理を行ってから次の分離工程に送る。アミノ酸やペニシリンのように目的物質が菌体外に分泌される場合は、遠心分離またはろ過によって菌体分離の前処理を行って次の分離工程に送る。
分離工程の目的は粗分離であり、抽出、イオン交換、吸着、UF膜分離および沈澱・晶析が使われる。アルコールなどでは蒸留が使われるが分子量が大きくなるとあまり使われない。次の精製工程は製品としての純度を保証する工程で晶析、クロマトグラフィー、電気泳動などによる分離精製である。
最終製品は保管及び輸送目的のために、乾燥固化できるものはできるだけ乾燥固化する。この工程では蒸発、UF膜による脱塩・脱水を行い乾燥機で乾燥させる。
バイオプロセスにおける分離精製は発酵工程の後工程(Down Stream)のみならず原料中の発酵阻害物質の除去またはDown Streamで悪影響を与える恐れのある不純物を予め除去するために行われる。
分離精製プロセスの構築法
プロセス構築にあたっては現時点で工業レベルで利用できる技術を基盤としその上に立った演繹的構成と実験によって裏付けをしつつ改良する帰納的手法を併用して短期間の間に作業を行なわなければならない。
留意すべき点
生産規模と生産寿命の予測より設備は汎用性を持たせる必要があるのかバッチ方式か連続運転が有利なのかの選択を行う。
また医薬品以外の製品では基本的構成を決定した後、よりよい方法が見つかった時変更は比較的容易であるが、医薬品においては簡単には変更できない。医薬品製造の場合、その品質保証のため前臨床試験の段階で採用したプロセスを臨床試験ならびに製造時においても使わなければならないというというのが製造認可の基本になっているからである。したがってプロセスは少なくとも前臨床試験の段階までに確定しておく必要がある。このように分離精製プロセスの構築は決して培養工程の付随的なものではなく、コスト・品質両面からみても分かるように製造プロセスの中核をなすものであることを忘れてはならない。
プロセス構築の手順
演繹と帰納とを併用して分離プロセスを構築する手順を概略すると図‐2のようになる。

(1)プロセス設計要求条件の確立
先ずプロセス設計に必要なのはそのプロジェクトの目的である、目的物質の生産量、品質、目標製品価格、開発期間を明確にしなければならない。ここで重要なのは上流である培養工程さらには微生物そのものの特性も十分把握する必要があるので分離精製研究者および技術者は、培養プロセス、微生物研究者、技術者と連携を密にした協力体制の基にこれを行わなければならない。
図‐2に諸要件の一部を記載したが特に重要なのは製品の純度、その分析法、培養液の組成、生産量、価格などである。
(2)製品・不純物の物性調査
製品および既知の不純物の物性を調べ、もしも不明ならば測定する必要がある。全ての不純物を把握するのは不可能である場合は、その不純物の挙動を把握できるように分析法を決めておく必要がある。
(3)単位操作のリストアップとその取捨選択
現時点で知られている全ての分離精製単位操作をリストアップしてみる。このためには膨大なデータベースが必要になる。このため日頃から最新の技術情報を追加しておくことが重要である。
このデータベースに入れておくのは分離精製単位操作の種類、性能、制約条件、設計法などである。さらに溶剤、膜の種類、吸着剤、イオン交換樹脂などの性能、物性の他、ろ過機、遠心分離機、ホモジナイザー、ポンプなどの機械分離機器ならびに計測機器などの型式と性能等の要素技術のデータも必要となる。
次にリストアップされた単位操作、要素技術の中で明らかに目的とする分離に適していないものをリストから除外して行く。その判断基準として:
(イ) 収率の非常に低いもの
(ロ) 製品規格に悪影響を与えるもの
(ハ) 毒性を有する分離剤(溶剤)を使用するもの
(ニ) 開発に長時間を要する可能性の在るもの
を上げることができる。
(4)プロセスの合成
プロセスの合成というのは単位操作の配列順の素案をいくつか作成することである。 プロセス合成にはいろいろなアプローチの仕方がある。
一般的な方法は、不純物を取り除くことに主眼をおいて、先ず不純物を粗取りし次に中取り最後に微量の不純物を除去するという論理的な方法である。
またコストは処理容量に比例することが多いので出来るだけ最初の段階で目的成分の濃度を上げておくとか、収率の低い単位操作は純度の高くなっている下流では使わないという判断基準でプロセスを合成することもできる。
いずれにしても各単位操作の収率には限度があるので分離精製プロセス全体の収率向上のためには単位操作の段数をできるだけ少なくするように配列することが大切である。このためには、沢山ある不純物を除去するためにそれに適した単位操作を適用するという判断基準ではなく、目的物質を多くの不純物の中から少ない単位操作で回収するという基準で単位操作を採用し、できるだけ重複を避けるように心掛ける必要がある。
またプロセスを構成するのは目的生成物を高収率で得るのみならず、それより派生する廃棄物の処理にも大いに配慮しなければならない。
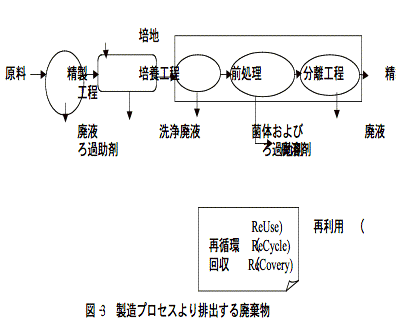
これら系より排出される廃棄物の処理をも含めたプロセス構築を行わなければこれらの処理コストの占める比率が高くなり製造コストを押し上げる大きな要因になるので注意が肝要である。
このような諸要因を加味したロジックを用いた人工知能プログラムも組むことができる。人工知能プログラムはそのデータベースとして(3)での分離精製単位操作・要素技術に関する情報に加えて(1)のプロセス設計での要求条件および(2)の製品および不純物の物性データも入れこむ必要がある。
より経験を積んだ人にとっては以上のよな系統立った方法の他に経験に裏打ちされた直感でプロセスを構築する場合がある。勿論その人特有の偏見も入ってくるがそれだけに強固であり時には新たな発想につながるものもある。
(5)プロセスの選定
前の段階でいくつか合成されたプロセスに関してコスト試算を行い、最終製品のコストが市場価格に対抗できるか否かという基準で色々な案を評価する。このコスト評価では変動費のみならず周辺設備をも含めた固定費をも含めて評価を行う。この他コスト評価には入らない、環境アセスメント評価、法規制に合格しているか、開発期間、プロセスの信頼性といった項目についても評価しなければならない。
このようにプロセスの評価基準としては経済性、信頼性、それに安全性が重要である。プロセスの経済性は、製品の品質と量が同じならば製造コストによって評価され次のように表される。
[製造費用]=[固定費]+[変動費]+[廃棄物処理費用]−[副製品収入]
ここで [固定費]=[設備投資額/償却年数]×(係数)
[変動費]=[原料費]+[エネルギー費]+[用役費]
である。
以上の評価を通して絞り込まれた案として提示された単位操作の配列順序を入れ替えて効果を見るのも時に有効である。
以上の評価の過程で各単位操作の性能確認および単位操作の配列の有効性を確認するためLaboratory-scaleでの実験を行う。この実験は次段階であるパイロットプラントでのスケールアップのためのデータとしても用いられる。
以上の手順を繰り返して満足の行くものを最終的に選択する。
(6)パイロットプラントでの実証実験
前段階で決定したプロセスに基づき実験データを基にしてパイロットプラントを設計して実証実験を行う。ここでは主に信頼性、および再現性に重点をおいて実験を行う。 医薬品の場合はここで得られた製品を用いて臨床実験を行い、食品の場合は市場調査に使われる。
発酵生産物での分離精製プロセス
工業分離精製プロセスとして、発酵法で生産されているアミノ酸の分離精製プロセスについて簡単に紹介する。
代表的な例として、発酵法によるL-グルタミン酸ナトリウム(味の素)の分離精製プロセスを図‐4に示した。
図から明らかなように分離精製プロセスは対象物質の特性と要求される製品の品質および形状によりコストミニマムになるような単位操作の組み合わせが選定されている。
グルタミン酸ナトリウム製造に用いられる原料としては、最も安価な炭素源であるモラセス(糖蜜)が多く用いられているがその組成は産地、収穫時期、製糖方法により大きなバラツキがあるが次の範囲にある。
| 水分 糖分 非糖成分 無機成分 |
15~20% 50~60% ショ糖、(グルコース、フラクトース) 10~20% 非資化性成分 10~15% K2O、Na2CO3が主成分 |
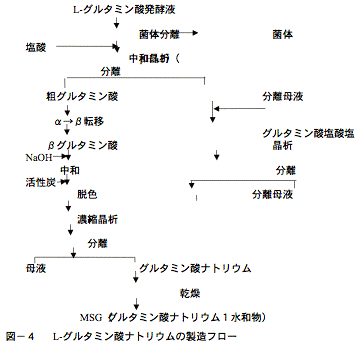
モラセス中の糖分に対して非資化性糖分および無機成分の比率は60%にも達し、これらが不純物として発酵液の中に含まれることになる。また培養中に目的生産物以外の副生物の生成も避けられずこれらも分離精製の立場からすると不純物となる。したがって原料由来の不純物、発酵プロセスで副生する不純物をどの段階で淘汰するか、多少発酵プロセスでの収率を犠牲にしても副生物の生成を最小に抑え全体の収率を上げる条件はないか、といったトータルプロセスでのコストミニマムを指向したプロセス構築を考えなければならない。
晶 析
固液平衡関係が単純共晶系を形成する多くの物質においては溶液から目的生産物を結晶として析出させ、溶液と分離する晶析分離方法では原理的には100%純度の結晶が得られることになるので分離精製手段として大変有効な手段といえる。しかしながら実際に得られる結晶は母液を結晶内に取り込んでいたり、分離に際して結晶と一緒に母液が付着同伴する現象が不可避でありこれらが純度低下の原因になっている。
図−5に示したグルタミン酸ナトリウムの製造フローでは、4種類の晶析を行い、活性炭による脱色工程を除けば晶析工程のみで分離精製プロセスを構成していることがわかる。
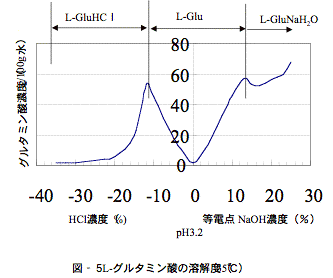
図−5には酸・アルカリ共存下におけるグルタミン酸およびその塩類の溶解度を示したが、等電点pH=3.2での溶解度が非常に低いことがわかる。これを利用してまず菌体分離を行った除菌発酵液に酸を加えて等電点3.2にするとピラミッド型のグルタミン酸の結晶が析出してくるのでこれを遠心分離機で分離する。グルタミン酸結晶にはα型とβ型の2多形の結晶があり、粗結晶で得られるのはα型である。このα型結晶は沈降性の良好な結晶であるが準安定形であるので管理を怠ると安定形であるβ型に転移するのでここでの留意点はα型グルタミン酸結晶を安定に析出させ分離することにある。
一旦分離したα型結晶はスラリー状にして加温することにより安定形であるβ型に転移する。その転移の際に結晶内に含まれていた不純物は系外に放出され高純度のグルタミン酸結晶となる。この工程が2番目の晶析工程である。ただスラリーを加温するのみの操作であるが純度向上は著しく、これにより数段のプロセスを簡略できるようになった。
β型グルタミン酸結晶をカセイソーダで中和してグルタミン酸ナトリウム溶液とし、活性炭で脱色し、減圧下での濃縮晶析で柱状のL−グルタミン酸ナトリウム1水和物結晶を得る。この結晶は商品になるので出来た結晶を破砕することなく分離し、乾燥・篩分して食品添加物規格に準拠した商品として出荷している。
グルタミン酸粗結晶母液からのグルタミン酸の回収に用いられるのがグルタミン酸塩酸塩の晶析である。母液中にはグルタミン酸が脱水閉環したピロリドンカルボン酸(PCA)が含まれているので母液を濃縮後、塩酸を加えて(PCA)を開環してグルタミン酸とする。分解液を冷却していくとグルタミン酸塩酸塩が析出してくる。この結晶は水に良く溶けるが図−5から分かるように塩酸濃度が高くなるとその溶解度は共通イオン効果で非常に低くなり高収率で母液よりグルタミン酸を回収することができる。またこのグルタミン酸塩酸塩は不純物の多い系からも純度のよい結晶として得られるので母液からの回収に適した晶析である。しかしながら高濃度の塩酸環境という過酷な条件であるため晶析缶、分離機等に耐酸性の材料を必要とするのが難点である。
まとめにかえて
以上述べたように分離精製プロセスは製品化技術の中核であり、その構築は非常に重要である。その構築に当たっては現在ある技術レベルを基盤にしつつも、必ず実験による確認を行いながら信頼性の高いプロセスを構築して行かなければならない。工業化に成功するにはこれだけでは不充分で環境負荷、製品の安全性のチェックを常に心掛け注意を怠っては成らない。このためには各専門分野の協力を得る中とりまとめていく必要がある。
Home | ホームページ設立の趣旨 | 掲載予定の記事について
豊倉賢略歴 | apppendix | 新規掲載記事
![]()