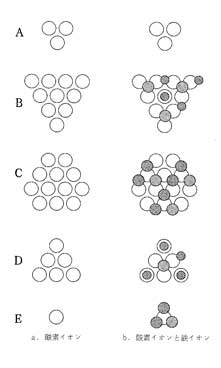
四酸化三鉄の結晶模型を少し角度を変えて見ると、酸素イオンがFe2O3と同じように並んでいる面が見つかりました。この正三角形になる並び方を、「三角並べ」と呼ぶことにしました。四酸化三鉄の結晶模型を見ながら、この「三角並び」の酸素イオンの層を上から順に取り出してみると、右の図ー5のようなA〜Eの5つの層になりました。
次に、鉄イオンを結晶模型にあわせて、A〜Eの三角並びの酸素イオン層にのせました。
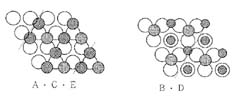
C層ではすべての鉄イオンが、酸素イオン3個の間にあるくぼみにのっています。ところが、BとD層ではいくつかの鉄イオンが酸素イオンの真上にきます。ある人が「A〜E層を集めたらつながらないだろうか?」というのでやって見たところ、見事につながって2つのひし形になりました。
どちらも、16個の酸素イオンと12個の鉄イオンでできています。A・C・E層(図ー6左)では、Fe2+(3.5cm球)が4個、Fe3+(3.5cm球)が8個です。B・D層(図ー6右)では、Fe2+(3.5cm球)が4個、Fe3+(2.5cm球)が8個でした。
A・C・E層もB・D層も、酸素イオン4個あたり3個の鉄イオンがのっています。A・C・E層では、すべての鉄イオンが酸素イオンの右下にあるくぼみにのっていますが、B・D層では2.5cmのFe3+が酸素イオンの真上と酸素イオン3個がつくるくぼみにあり、 Fe2+が、酸素イオン3個がつくるくぼみにあります。
もとの結晶模型では、A・B・C・D・Eと重なっていたのですから、四酸化三鉄ではA・C・E層とB・D層とが交互に重なっていることになります。
四酸化三鉄の結晶模型も「三角並べ」にして見ると、鉄イオンの並び方の規則性が分かりやすくなりました。上にのる酸素イオンも合わせて見ると、次のようになっています。
2.5cmの鉄イオンでは、真下に1個と上で3個の酸素イオンが接しているものと、下で3個と真上に1個の酸素イオンに接しているものがありました。したがって、これらの鉄イオンは上下合わせて4個の酸素イオンと接しています。4個の酸素イオンに囲まれた間隙に入っているともいえます。
その他の鉄イオンは上で3個、下で3個の酸素イオンと接していました。上下合わせて6個の酸素イオンに囲まれた間隙に入っているわけです。Fe2O3ではすべての鉄イオンが6個の酸素イオンに囲まれた間隙に入っています。
一方、酸素イオンを中心において見る と、すべての酸素イオンが4個の鉄イ オンと接していました。そのうち3個は、3.5cm球、1個は2.5cm球です。大きい3個の鉄イオンを酸素イオンの下におくと、残り1個の小さい鉄イオンが酸素イオ ンの真上にきます。この酸素イオンを 中心においたユニットは、結晶の中ではさまざまな向きで並んでいます。とにかく、どの酸素イオンをとっても鉄イオンとの関係は同じということは、あまりにも単純で信じられない思いがしました。しかし、よく考えて見ると単純でなければ、多数のイオンが規則正しく並べないはずで、結晶の見事さを改めて感じさせられるものでした。