三酸化鉄(Fe2O3〕は、鉄イオン(Fe3+)2個と、酸素イオン(O2-)3個の割合で結合しています。
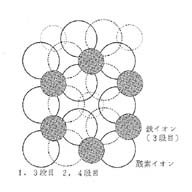
酸 素イオンは、 図・4のように、少 し離れて3個が三角形を形づくって並んでいます。このよう に並ぶと、隣り合った3個づつの 酸素イオンの中心にくぼみができます。酸素イオン1個当たり2 箇所のくぼみ(A、B)ができますが、そのうち1カ所 に鉄イオンが入っています。
ただし、3個の酸素イオンに対して鉄イオンは2個しかないので、3ヶ所のくぼみのうち1ヶ所には鉄イオンがありません。
鉄イオンは上下の並 びで見ても斜めの並びで見ても2 個毎に空所があります。この鉄イオンの中心を結ぶと蜂の巣 のような六角形になり ます。
この上に酸素イオンの層が 図のように重なります。3段目の 酸素イオンの層は、1段目の真上 にきます。4段目は2段目の真上 です。
酸素イオンの層は2段で1まわりしますが、鉄イオンの層は3 段で1まわりするようにずれて重な ります。したがって、酸素イオンと鉄イオンの並び方が、1段目と同じになるのは7段目です。
Fe3+の周りには6個のO2-が、O2-のまわりには4個のFe3+が接しています。
 図ー4
図ー4
