|
10月中旬 実施の同意(所属長) |
授業計画策定,遺伝子抽出,増幅,検出実験実施に関する実施機関の長(学校長)への届け出。説明の後,実施の同意をいただきました。 実施内容は,1.生徒自身の細胞から抽出したサンプルからPV21遺伝子の一部を増幅し,そのイントロンに挿入されたAlu配列の有無を電気泳動により確認する実験(練習としてBIO-RAD社の教育用キットを利用)。2.生徒にアルコールパッチテストを実施し,ALDH遺伝子の有無を推定(表現型)した後,抽出した細胞からALDH遺伝子を増幅し,ALDH遺伝子多型(遺伝子型)を確認する実験です。いずれも,生物1,生物2の授業の内容として実施します。 |
|
10月下旬 実施の同意(生徒) |
生徒に実験の内容を説明し,自分の遺伝子を抽出し,遺伝子型を確認することに同意するかどうかの同意書を書いてもらいました。実験内容を十分に説明し,自由意志で実験に参加できること,実験の結果を授業参加者には公表しても良いことに関する同意書に署名してもらいました。参加しない,あるいは,遺伝子型を明らかにすることに同意しなくても,そのことで一切の不利益を受けないことなどを説明し,全員から同意をもらいました。 |
|
11月10(金) 実験内容の説明 |
キットの生徒用マニュアルを元に作成したテキストを配付し,実習の内容を説明しました。この前の授業で,キイロショウジョウバエの遺伝の実験を終了しており,その発展として,ヒトの遺伝子を解析するというつながりを説明しました。 正確なピペット操作が必要なため,ピペットマンの操作をメチレンブルー溶液を使って練習しました。 |
|
11月13日(月)実習1日目 遺伝子の抽出 |
細胞を遠心して集めたあと,上清を捨てる時,細胞も捨ててしまう生徒がたくさんいました。遠心後,上清を捨てなくても細胞を回収することができました。 |
|
11月14日(火)実習2日目 遺伝子の増幅(PCR) |
細胞をボイルしたチューブから,インスタジーンマトリックスのビーズを取らないように,上清だけを取る操作が肝心です。 |
|
11月15日(水)実習3日目 PCR産物の電気泳動 |
泳動終了後,キットに添付のFast Blast DNA 染色液に入れて,オーバーナイトで染色し,さらに水洗後オーバーナイトで脱色しました。 授業終了後に,電気泳動を終了しましたが,そこに落とし穴が。 |
|
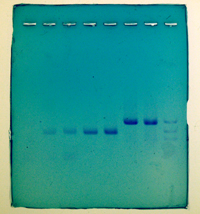
11月17日(木)実習4日目 結果の解析,考察 |
右の写真は1班のものです。左から1レーンは空きレーン,2レーンはサイズマーカー(1000bp,700bp,500bp),3レーンはヘテロコントロール(約941bp,約641bp)です。4レーンから7レーンが生徒のサンプルで,4レーンの生徒はヘテロ,5レーンは増幅に失敗,6,7レーンはプラスのホモという結果がわかります。 マニュアルにはローディングダイがゲルの3分の2ぐらい流れたら泳動をとめるよう指示がありましたが,それでは流し過ぎになります。同様にマニュアルにあるよう,35分の泳動時間は守るべきです。 |
|
|
サーマルサイクラーと遠心分離機の2品と試薬類は,今回初等中等教育研究奨励事業からの助成を受けて購入。ピペット,電気泳動層などは,これまでのSPP事業で購入したものです。 26人のクラスで一斉に実習するためには,遠心分離機が1台では順番待ちが出て,効率がよくありません。 多くの先生方のご支援により,やっと実施できた実験でした。
残してあったサンプルで,再度PCRを行ない,クイックステインを行ないました。クイックステインの場合は,染色に2分,そのあと数回すすぐだけで,バンドがはっきり見えて来ます。左の写真は,数回のすすぎのあと,3時間ほど脱色したものです, 右からサイズマーカー,(+/+)コントロール2レーン,(ー/ー)コントロール2レーン,私のサンプル(-/-)2レーンです。PCRに使ったテンプレートとマスターミックスの量,ゲルにアプライした量を変えてみました。コントロールのようにテンプレートさえちゃんとしていれば,テンプレート20μlに対してマスターミックス10μlでも,ちゃんと増幅できました。 |
 生理食塩水10mlでうがいをした液から,1mlをエッペンチューブにとり,遠心分離器にかけて細胞を沈澱させました。沈澱から20μlの細胞懸濁液をインスタジーンマトリックス(キレート剤により,DNA分解酵素の活性に欠かせないイオンを除去する)の入ったスクリューキャップ付きチューブにとって撹拌後,56度で10分プレヒートし,6分間100度のお湯につけて,細胞の膜構造を壊し,DNAを抽出しました。抽出後,冷蔵庫に保管しました。
生理食塩水10mlでうがいをした液から,1mlをエッペンチューブにとり,遠心分離器にかけて細胞を沈澱させました。沈澱から20μlの細胞懸濁液をインスタジーンマトリックス(キレート剤により,DNA分解酵素の活性に欠かせないイオンを除去する)の入ったスクリューキャップ付きチューブにとって撹拌後,56度で10分プレヒートし,6分間100度のお湯につけて,細胞の膜構造を壊し,DNAを抽出しました。抽出後,冷蔵庫に保管しました。 前日から冷蔵庫に保存してあったチューブを遠心機にかけ,インスタジーンマトリックスのビーズを沈澱させ,上清から鋳型DNA(テンプレート)をPCRチューブに20μlとり,あらかじめ混合(PCRミックスとプライマー)しておいたマスターミックス(20ml)を20μl入れ,タッピング後遠心機にかけ,サーマルサイクラーにセットしました。サーマルサイクラーには94度(1分),64度(1分),74度(2分)を40サイクル,その後4度で保存するようプログラムしました。
前日から冷蔵庫に保存してあったチューブを遠心機にかけ,インスタジーンマトリックスのビーズを沈澱させ,上清から鋳型DNA(テンプレート)をPCRチューブに20μlとり,あらかじめ混合(PCRミックスとプライマー)しておいたマスターミックス(20ml)を20μl入れ,タッピング後遠心機にかけ,サーマルサイクラーにセットしました。サーマルサイクラーには94度(1分),64度(1分),74度(2分)を40サイクル,その後4度で保存するようプログラムしました。
 サーマルサイクラーからPCRチューブを取り出し,ローディングダイを20ml加えて混合し,そこから20mlをアガロースゲルのウェルにアプライしました。別に増幅しておいたヘテロのコントロールと,DNAサイズマーカーも同様にアプライし,電気泳動のスイッチを入れました。
サーマルサイクラーからPCRチューブを取り出し,ローディングダイを20ml加えて混合し,そこから20mlをアガロースゲルのウェルにアプライしました。別に増幅しておいたヘテロのコントロールと,DNAサイズマーカーも同様にアプライし,電気泳動のスイッチを入れました。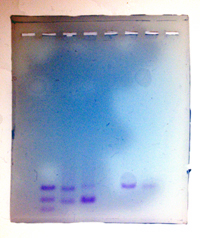 バンドが検出できました。しかし,泳動時間が長すぎて,一部の班ではDNA断片がゲルから流れ落ちてしまいました。Alu配列に関しては,プラスのホモの人とマイナスのホモの人が半々,ヘテロの人は4名ほどでした。
バンドが検出できました。しかし,泳動時間が長すぎて,一部の班ではDNA断片がゲルから流れ落ちてしまいました。Alu配列に関しては,プラスのホモの人とマイナスのホモの人が半々,ヘテロの人は4名ほどでした。